研究内容
- 実際に当研究室で行っている研究は以下に述べる限りではありません。
- 研究内容について詳しく知りたい方は直接お問い合わせください。
染色体は遺伝情報の担体であり、生命活動の根本を統御する構造体です。染色体の機能欠損や重複は、細胞死、がん、重篤な疾患を引き起こすことから、染色体機能に関する研究は、生命の基本原理を探るためだけでなく、人間の疾患発症メカニズムを探るためにも重要です。真核生物の線状染色体の末端に存在するドメインである「テロメア」は、生命を維持する上で非常に重要な役割を果たしています。近年の研究により、テロメアは”分裂寿命時計”と比喩されるように細胞老化や寿命と密接な関係があるだけでなく、染色体構造の維持や種の保存において必須の機能を果たしていることが明らかにされてきました。また、テロメアに隣接するドメインである「サブテロメア」は、テロメアとは対照的に機能解析があまり進んでおらず、いわば”染色体の未開の地”ですが、ヒトの様々な病気やゲノム進化との関わりが示唆されています。当研究室では、分裂酵母、ヒト細胞、大型類人猿細胞などを使って、分子生物学、分子遺伝学、生化学、細胞生物学、構造生物学など様々な手法によって、テロメアやサブテロメアが様々な生命現象(生命維持、多様化、進化、ヒトの病気発症など)にどのように関わっているのかを探る研究を行っています。
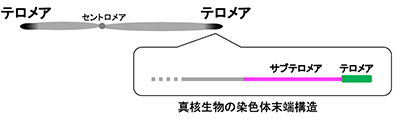
1.染色体末端テロメアによる染色体機能発現メカニズムの解明
テロメアは、真核生物の線状染色体の末端に存在する特殊な構造体であり、特殊な繰り返し配列からなるテロメアDNAとそれに結合する様々なタンパク質群からなります。テロメアは、染色体末端の保護、テロメラーゼ(テロメアDNA伸長酵素)によるテロメアDNA伸長、正常な減数分裂などに必要とされる重要な機能領域です。テロメア機能の異常は、がん、細胞死、不妊、異常な老化などを引き起こします。従って、テロメアの機能維持は生命維持や種の保存において極めて重要です。2009年のノーベル医学生理学賞は、テロメラーゼを発見したテロメア研究者に贈られ、テロメア研究のさらなる発展に対する期待が高まっています。また、iPS細胞作製の際にテロメアDNAの長さが回復することが知られており、発生分化制御におけるテロメアの重要性も注目されています。さらに、テロメアは他の染色体領域(セントロメアや複製開始点など)との機能関連も最近明らかにされつつあります。
私達は、テロメアに結合する様々なタンパク質の機能解析を行ってきました。中でも、Rap1タンパク質が様々なタンパク質と相互作用することによってテロメア機能の中枢としての役割を果たすことを明らかにしてきました。例えば、Rap1がCdc2キナーゼによってリン酸化されることにより、Rap1が核膜タンパク質Bqt4から解離し、それによってテロメアが核膜から離れて染色体の動きがスムーズになり、細胞分裂期の正確な染色体分配が保障されていることを発見しました(Fujita et al., 2012)。また、Rap1のカゼインキナーゼ2 (CK2)によるリン酸化がテロメア結合タンパク質複合体の形成に重要であることを明らかにしました(Inoue et al, 2019)。他にもテロメアに関する多数の論文を発表しています(詳しくは論文リストをご覧ください)。今後は、分子遺伝学、生化学、細胞生物学的手法などを駆使して、Rap1や他のテロメアタンパク質がいかにして染色体(ゲノム)や細胞寿命の維持に寄与しているのか、テロメアは他の染色体ドメインとどのように機能相関しているのかなど、様々な角度から未知なるテロメア機能を明らかにしていきたいと考えています。
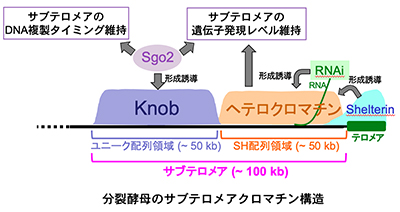
2.テロメア隣接領域サブテロメアの機能解明
サブテロメアにはテロメアの繰り返し配列は存在せず、多種類の長大な共通配列がモザイク状に組み合わさった複雑な構造をとっています。それが原因で様々な解析が困難になり、サブテロメアはテロメアに比べて研究が進んでいません。しかし、精神遅滞や多発奇形を呈するヒトのサブテロメア微細構造異常症や筋ジストロフィーなどの病気はサブテロメアの構造異常が原因と考えられていることから、医療面からサブテロメアの機能や構造維持メカニズムの究明が期待されています。当研究室では、サブテロメアに形成される特殊なクロマチン構造(染色体高次構造)の形成機構や機能について解析を世界に先駆けて進めています。これまでに、テロメアに隣接する領域では、テロメア結合タンパク質Taz1やRNAi機構によってヒストンH3-Lys9残基が高度にメチル化されたヘテロクロマチンが形成されることを明らかにしました(Kanoh et al., 2005)。さらに、そのヘテロクロマチンに隣接する領域では、細胞分裂期にセントロメアで正確な染色体分配に寄与するSgo2タンパク質が間期にサブテロメアにリクルートされてknobと呼ばれる高度に凝縮したクロマチン構造の形成を誘導し、サブテロメア遺伝子群の転写調節や、サブテロメア領域のDNA複製タイミングの維持において重要な役割を果たしていることを明らかにしました(Tashiro et al., 2016)。さらに、サブテロメアの共通配列をゲノムからすべて取り除いた細胞の作製に成功し、サブテロメアがゲノム維持や遺伝子発現維持などの重要な機能をもつことを明らかにしました(Tashiro et al., 2017)。現在、高度に凝縮されたknob構造がどのようにして形成されるのか、サブテロメアというドメインの範囲を決定する機構はどのようなものか、などを探っています。
最近の当研究室および他の研究者の研究により、サブテロメアは非常に変化が激しいゲノム領域であることがわかりつつあります。つまり、ゲノム進化のメッカです。その性質によって、サブテロメアの構造変化を原因とするヒトの様々な病気が引き起こされますが、逆に、生物の多様化、進化をもたらす原動力ともなりえます。そこで、サブテロメアはなぜ変化に富むのか、サブテロメアが多様化やゲノム進化にどのように貢献してきたのかということを明らかにする研究も進めています。例えば、ヒトのサブテロメアは様々な条件(がん化、老化、ストレス環境下など)でどのような変化を見せるのか、それが細胞機能にどのような影響を与えるのか、さらにヒトの人種、生活環境、性別、年代、マウスを使って発生過程、老化などによってサブテロメアはどのように異なるのかなどを解析しようとしています。
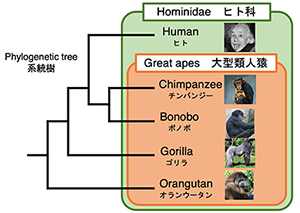
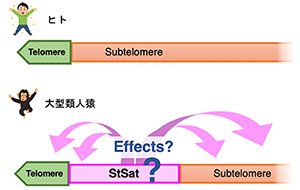
一方、大型類人猿(チンパンジー、ボノボ、ゴリラ、オランウータン)はヒトと進化的に最も近いとされています。特に、ヒトとチンパンジーのDNA配列の違いはわずか数%と言われています。しかし、我々ヒトとチンパンジーには、骨格、歩行形態、言語の使用、脳の体積、寿命など、様々な違いがあります。このような違いは、わずか数%のDNA配列の違いですべて説明できるのでしょうか? 実は、ヒトと大型類人猿の間には、比較ができない染色体構造の根本的な違いが存在します。まず、ヒトは23組46本の染色体をもちますが、大型類人猿は24組48本です。さらに興味深いことに、ヒトの染色体末端はテロメアーサブテロメアと並んでいますが、大型類人猿ではテロメアとサブテロメアの間にSubtermimal Satellite (StSat)という繰り返し配列が存在します。このStSat領域がどのようなクロマチン構造をとり、どのような機能をもっているのか、それがヒトと大型類人猿の性質の違いに関係しているのか、ヒトをヒトたらしめているものは何か?などを明らかにしようとしています。
今後も世界に先駆けて、新しい発見をしていくことを目指しています。


